|
||||||||
Хімія
|
Карбон (II) і карбон (IV) оксиди. Силіцій (IV) оксид. Їх властивості, застосування. Поняття про парниковий ефект Відомі два оксиди Карбону: CO і CO2. Відомі два оксиди Карбону: CO і CO2.Карбон (II) оксид має молекулярну формулу CO2. Його ще називають чадним газом. Він безбарвний, без запаху, погано розчиняється у воді. Дуже отруйний. Чадний газ утворює стійку сполуку з гемоглобіном крові. Внаслідок цього кров втрачає властивість переносити кисень в організмі. Настає кисневе голодування. Карбон (II) оксид є несолетворним оксидом. Він реагує з киснем, утворюючи карбон чотири оксид CO2, і відновлює метали з їх оксидів. |
Карбонатна кислота і карбонати. Якісна реакція на карбонат-іони. Взаємоперетворення карбонатів. Поняття про кислі солі Карбонатна кислота має молекулярну формулу H2CO3. Належить до слабких кислот, існує лише в розчині. Нестійка сполука. При нагріванні розчину карбонатна кислота розкладається на вуглекислий газ і воду. Карбонатна кислота має молекулярну формулу H2CO3. Належить до слабких кислот, існує лише в розчині. Нестійка сполука. При нагріванні розчину карбонатна кислота розкладається на вуглекислий газ і воду.Як двохосновна кислота, карбонатна кислота дисоціює ступінчасто. Утворює дві групи солей: кислі та середні. Кислі солі мають назву гідрогенкарбонати. Наприклад, NaHCO3 натрій гідроген карбонат. Середні солі називаються карбонати. Наприклад, Na2CO3, натрій карбонат. |
Поняття про твердість води. Кругообіг Карбону в природі. Силікатна кислота й силікати, їх властивості, застосування Твердість води зумовлена наявністю у ній йонів кальцію та магнію. Розрізняють тимчасову твердість води (або карбонатну) і постійну твердість (або некарбонатану). Твердість води зумовлена наявністю у ній йонів кальцію та магнію. Розрізняють тимчасову твердість води (або карбонатну) і постійну твердість (або некарбонатану). Карбонатна твердість спричинюється наявністю у воді гідроген карбонатів кальцію і магнію. Вона усувається кип’ятінням. Некарбонантна твердість обумовлюється наявністю у воді сульфатів, хлоридів, нітратів тощо кальцію та магнію. Її можна усунути додаванням соди або пропусканням води через йонообмінник. |
Поняття про органічні сполуки. елементи-органогени. Спільні та відмінні ознаки неорганічних та органічних сполук. Природні й синтетичні органічні речовини Органічними називаються сполуки, до складу яких входить елемент Карбон. Однак такі найпростіші сполуки Карбону як його оксиди, карбонатна кислота та її солі належать до неорганічних сполук, бо вони за складом і властивостями дуже близькі до них. Органічними називаються сполуки, до складу яких входить елемент Карбон. Однак такі найпростіші сполуки Карбону як його оксиди, карбонатна кислота та її солі належать до неорганічних сполук, бо вони за складом і властивостями дуже близькі до них. Крім Карбону, органічні сполуки найчастіше містять елементи Гідроген, Оксиген, Нітроген; значно рідше - Сульфур, Фосфор, галогени і деякі метали. Неорганічні та органічні сполуки мають спільні та відмінні ознаки. |
Метан - найпростіша органічна сполука. Його склад, електронна і структурна формули, тетраедрична будова молекули. Фізичні властивості, поширення в природі Метан - це найпростіша органічна сполука. До складу молекули метану входять один атом Карбону і чотири атоми гідрогену. Молекулярна формула метану СН4. Метан - це найпростіша органічна сполука. До складу молекули метану входять один атом Карбону і чотири атоми гідрогену. Молекулярна формула метану СН4. Молекула метану має тетраедричну будову. Це пояснюється тим, що у атома карбону в збудженому стані на зовнішньому електронному шарі міститься чотири неспарені електрони. За допомогою цих чотирьох неспарених електронів атом Карбону утворює чотири ковалентних зв’язки з атомами |
Хімічні властивості метану: горіння, термічний розклад, хлорування. Застосування метану та його галогенопохідних Метан має такі хімічні властивості. Він горить, утворюючи вуглекислий газ і воду. Метан має такі хімічні властивості. Він горить, утворюючи вуглекислий газ і воду.CH4 + 2O2 → CO2 + 2H2O. Горіння метану супроводжується виділенням великої кількості теплоти. У разі нестачі кисню метан окиснюється не повністю. І тоді замість карбон(IV) оксиду CO2 утворюється карбон(II) оксид CO, відомий як чадний газ. |
Гомологічний ряд метану. Загальна формула парафінів. Молекулярні й структурні формули гомологів метану, гомологічна різниця. Зигзагоподібна будова карбонового ланцюга. Фізичні властивості насичених вуглеводнів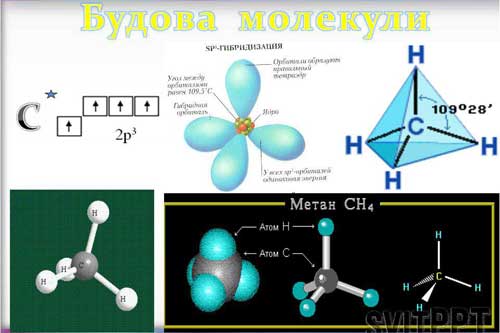 Сполуки, які подібні за будовою та хімічними властивостями, але відрізняються одна від одної за складом молекул на одну або кілька груп CH2
, називаються гомологами. Група CH2
називається гомологічною різницею. Гомологи утворюють гомологічний ряд, першим членом якого є найпростіша речовина, у даному разі це метан. Сполуки, які подібні за будовою та хімічними властивостями, але відрізняються одна від одної за складом молекул на одну або кілька груп CH2
, називаються гомологами. Група CH2
називається гомологічною різницею. Гомологи утворюють гомологічний ряд, першим членом якого є найпростіша речовина, у даному разі це метан.Речовини гомологічного ряду метану ще називають насиченими вуглеводнями, парафінами або алканами. Насиченими називаються вуглеводні, у молекулах яких атоми карбону сполучені між собою простим (одинарним, сигма-) зв’язком, а всі інші валентності насичені атомами Гідрогену. |
Хімічні властивості насичених вуглеводнів: відношення до розчинів кислот, лугів, калій перманганату, повне та часткове окислення, термічний розклад, галогенування За хімічними властивостями насичені вуглеводні дуже схожі на метан. Вони горять, утворюючи CO2 і воду. Розкладаються при нагріванні. За хімічними властивостями насичені вуглеводні дуже схожі на метан. Вони горять, утворюючи CO2 і воду. Розкладаються при нагріванні. При цьому за різних температур відбувається реакція повного розкладу на прості речовини вуглець і водень або неповного розкладу (дегідрування). Насичені вуглеводи не знебарвлюють розчин калій перманганату, бромну воду, не окиснюються розчинами кислот і лугів, не вступають у реакції приєднання. |
Явище ізомерії. Ізомери насичених вуглеводнів. Міжнародна номенклатура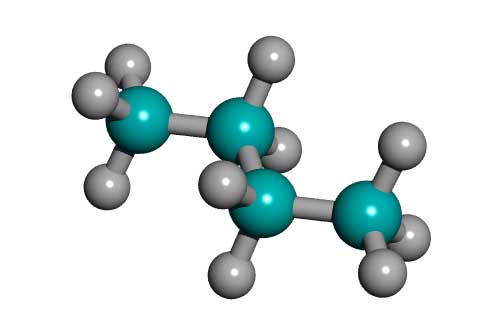 Ізомерами називаються органічні речовини, які мають однаковий якісний і кількісний склад молекул, але різну будову, і тому різні фізичні та хімічні властивості. Ізомерами називаються органічні речовини, які мають однаковий якісний і кількісний склад молекул, але різну будову, і тому різні фізичні та хімічні властивості.Наприклад, склад етилового спиту і диметилового ефіру виражається однією емпіричною формулою C2H6O, але властивості їх різні: етиловий спирт - це рідина з температурою кипіння 78 °С, а диметиловий ефір - газ, що зріджується при температури мінус 24 °С. |
Залежність властивостей речовин від їх хімічної будови. Теорія хімічної будови органічних сполук О. Бутлерова Залежність властивостей речовин від їх хімічної будови яскраво ілюструється на прикладі ізомерів. Цей взаємозв’язок пояснює теорія хімічної будови органічних сполук, автором якої є видатний російський учений Олександр Михайлович Бутлеров. Основні положення теорії Бутлеров сформулював у 1861 р. Залежність властивостей речовин від їх хімічної будови яскраво ілюструється на прикладі ізомерів. Цей взаємозв’язок пояснює теорія хімічної будови органічних сполук, автором якої є видатний російський учений Олександр Михайлович Бутлеров. Основні положення теорії Бутлеров сформулював у 1861 р.Теорія стверджує, що атоми у молекулі сполучаються не будь-як, а в певній послідовності відповідно до їх валентності. Така послідовність сполучення атомів називається хімічною будовою, а відображається вона структурною формулою. |
|
|
|
ЕНЦИКЛОПЕДІЯ КОРИСНОГО
|













