|
||||||||
Хімія
|
Нітроген і Фосфор, їх місце в Періодичній системі будови атомів. Алотропні модифікації Фосфору. Азот і Фосфор як прості речовини: будова молекул, поширення в природі. Фізичні властивості азоту і фосфору. Хімічні властивості азоту та фосфору: взаємодія з металами, воднем, киснем. Застосування Нітроген і Фосфор у Періодичній системі хімічних елементів знаходяться в головній підгрупі п’ятої групи. На зовнішньому енергетичному шарі обидва елемента містять по 5 електронів у стані s2p3. Тому найвищий ступінь окиснення цих елементів дорівнює +5, найнижчий - –3. Нітроген і Фосфор у Періодичній системі хімічних елементів знаходяться в головній підгрупі п’ятої групи. На зовнішньому енергетичному шарі обидва елемента містять по 5 електронів у стані s2p3. Тому найвищий ступінь окиснення цих елементів дорівнює +5, найнижчий - –3.Відмінність полягає у тому, що в атомі Фосфору на зовнішньому електронному шарі є вільні d-орбіталі. Це дає можливість йому приходити у збуджений стан. |
Амоніак: будова молекули, одержання в лабораторії. Фізичні та хімічні властивості амоніаку. Взаємодія з киснем, водою, кислотами. Застосування амоніаку Молекулярна формула аміаку NH3. У молекулі аміаку атом Нітрогену пов’язаний із трьома атомами Гідрогену ковалентним полярним зв’язком. Густина його зміщена у бік атома Нітрогену, як більш електронегативного. І тому молекула аміаку являє собою диполь. Молекулярна формула аміаку NH3. У молекулі аміаку атом Нітрогену пов’язаний із трьома атомами Гідрогену ковалентним полярним зв’язком. Густина його зміщена у бік атома Нітрогену, як більш електронегативного. І тому молекула аміаку являє собою диполь.У лабораторії аміак добувають слабким нагріванням суміші амоній хлориду NH4Cl з гашеним вапном Ca(OH)2. |
Солі амонію. Фізичні властивості солей амонію. Хімічні властивості: взаємодія з лугами, солями, розкладання під час нагрівання. Якісна реакція на йони амонію, одержання солей амонію в лабораторії Солі амонію складаються з катіона амонію NH4+ та аніона кислоти. За будовою вони аналогічні солям лужних металів. Солі амонію складаються з катіона амонію NH4+ та аніона кислоти. За будовою вони аналогічні солям лужних металів.За фізичними властивостями солі амонію - це тверді кристалічні речовини. Добре розчиняються у воді. Солі амонію виявляють типові для всіх солей хімічні властивості і деякі специфічні. Як і всі розчинні солі, солі амонію у водному розчині добре дисоціюють на йони, взаємодіють із лугами, сильними кислотами, іншими солями. |
Промисловий синтез амоніаку: вибір оптимальних умов синтезу, будова й робота колони синтезу Основним способом добування аміаку в промисловості є синтез його з азоту і водню: N2 + 3H2 ® 2NH3. Ця реакція є оборотною, екзотермічною та відбувається лише при наявності каталізатора. Основним способом добування аміаку в промисловості є синтез його з азоту і водню: N2 + 3H2 ® 2NH3. Ця реакція є оборотною, екзотермічною та відбувається лише при наявності каталізатора.Основним завданням будь-якого виробництва є не просто добути задану речовину, а добути її найбільш економічним способом. А для цього необхідно підібрати оптимальні умови синтезу, тобто такі, за яких вихід продукту буде найбільшим і процес здійснюватиметься з великою швидкістю. |
Нітроген(II) і нітроген(IV) оксиди. Фосфор (V) оксид. Їх фізичні та хімічні властивості. Застосування Нітроген з Оксигеном утворює шість оксидів, у яких він виявляє ступені окиснення від +1 до +5, це оксиди складом відповідно N2O, NO, N2O3, NO2, N2O4. З них при безпосередньому сполученні азоту з киснем утворюється лиш нітроген(II) оксид NO. Нітроген з Оксигеном утворює шість оксидів, у яких він виявляє ступені окиснення від +1 до +5, це оксиди складом відповідно N2O, NO, N2O3, NO2, N2O4. З них при безпосередньому сполученні азоту з киснем утворюється лиш нітроген(II) оксид NO. Інші оксиди добувають непрямими способами. З оксидів азоту два оксиди є несолетворними. Це нітроген один оксид N2O і нітроген два оксид NO. Усі інші оксиди - солетворні. Усі оксиди Нітрогену дуже отруйні, за винятком N2O. Розглянемо нітроген (II) оксид і нітроген(IV) оксид. |
Нітратна й ортофосфатна кислоти. Їх фізичні та хімічні властивості Молекулярна формула нітратної кислоти HNO3. Це безбарвна рідина з їдким запахом. На повітрі «димить». Дуже добре розчиняється у воді, змішуючись з нею у будь-яких співвідношеннях. Кипить при температурі 86 °С. Молекулярна формула нітратної кислоти HNO3. Це безбарвна рідина з їдким запахом. На повітрі «димить». Дуже добре розчиняється у воді, змішуючись з нею у будь-яких співвідношеннях. Кипить при температурі 86 °С.Нітратна кислота - сильний електроліт, у водному розчині практично повністю дисоціює на йони. Розведена нітратна кислота має хімічні властивості, типові для всіх кислот. Вона реагує з оксидами металів, основами, солями більш слабких кислот. Концентрована нітратна кислота - сильний окисник. Вона активно реагує з неметалами, розкладається при нагріванні і під впливом світла. |
Особливості взаємодії розбавленого і концентрованого розчинів нітратної кислоти з міддю. Застосування нітратної й ортофосфатної кислот Нітратна кислота реагує з металами інакше, ніж інші кислоти. Це пояснюється тим, що вона - сильний окисник. Нітратна кислота окислює майже всі метали. Нітратна кислота реагує з металами інакше, ніж інші кислоти. Це пояснюється тим, що вона - сильний окисник. Нітратна кислота окислює майже всі метали. При цьому слід пам’ятати, що концентрована нітратна кислота не реагує з алюмінієм, залізом, хромом, іридієм, танталом. Вона їх пасивує. Тому її зберігають і перевозять у тарі, виготовленій із цих металів. |
Загальні відомості про нітратні та фосфатні добрива. Кругообіг Нітрогену в природі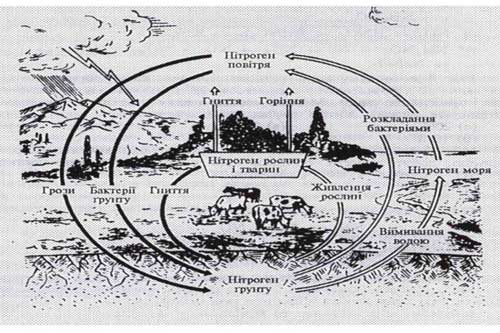 Наука про живлення рослин і застосування добрив з метою підвищення врожайності сільськогосподарських культур та поліпшення якості врожаю називається агрохімією. Наука про живлення рослин і застосування добрив з метою підвищення врожайності сільськогосподарських культур та поліпшення якості врожаю називається агрохімією.Велику роль у становленні агрохімії відіграли французький вчений Жан Буссинго та німецький хімік Юстас Лібіх. Жан Буссенго вперше дослідив кругообіг речовин у землеробстві та роль Нітрогену в живленні рослин. Юстас Лібіх уперше обґрунтував теорію виснаження ґрунтів через винесення поживних речовин. |
Карбон і Силіцій, їх місце в Періодичній системі, будова атомів. Алотропні модифікації Карбону Карбон і Силіцій знаходяться у головній підгрупі четвертої групи Періодичної системи хімічних елементів. Карбон - елемент другого періоду, Силіцій - третього. Карбон і Силіцій знаходяться у головній підгрупі четвертої групи Періодичної системи хімічних елементів. Карбон - елемент другого періоду, Силіцій - третього. Атоми цих елементів на зовнішньому електронному шарі містять по чотири електрони у стані s2p2. Цим пояснюється подібність їхніх хімічних властивостей. Зі схем будови атомів Карбону і Силіцію випливає, що у звичайному стані ці елементи двовалентні, тому що їх атоми мають на зовнішньому електронному шарі два неспарених електрони. У збудженому стані вони чотиривалентні: на зовнішньому шарі атоми мають чотири неспарених електрони. |
Хімічні властивості вуглецю та силіцію: взаємодія з киснем, воднем, відновні властивості За звичайних умов вуглець виявляє невисоку хімічну активність. Більшість реакцій за його участю відбувається лише за високої температури. За звичайних умов вуглець виявляє невисоку хімічну активність. Більшість реакцій за його участю відбувається лише за високої температури.Силіцій ще менше активний, ніж вуглець. За низьких температур він навіть хімічно інертний, а при нагріванні його реакційна здатність різко зростає. Найголовніша хімічна властивість вуглецю і силіцію - це їх відновна здатність. Вуглець - один із найкращих відновників. |
|
|
|
ЕНЦИКЛОПЕДІЯ КОРИСНОГО
|